Cet article décrit le processus de déshydrogénation, c’est-à-dire comment l’hydrogène est retiré d’un système d’hydrogène à l’état solide.
Déshydrogénation #
Dans un matériau porteur d’hydrogène saturé, les atomes d’hydrogène sont intégrés dans la structure en réseau de l’hydrure métallique. Lorsque l’hydrogène est extrait du stockage, la pression autour de ce matériau saturé à l’état solide diminue. Cela crée une différence de pression entre la pression de plateau de l’hydrure métallique et la pression du gaz environnant. Le différentiel entraîne les atomes d’hydrogène à l’interface entre le corps solide et le gaz. Là, ils se recombinent et forment de l’hydrogène moléculaire (H2). Ces molécules H2 passent ensuite en phase gazeuse.
Le processus de recombinaison et de libération de l’hydrogène est endothermique. La raison en est que de l’énergie est nécessaire pour rompre les liaisons hydrogène-métal dans le réseau d’hydrure métallique. Ce besoin énergétique met en évidence la complexité et la complexité du processus de déshydrogénation, car il implique l’absorption de chaleur pour faciliter la libération d’hydrogène gazeux. La représentation graphique de la figure ci-dessous illustre ce phénomène.
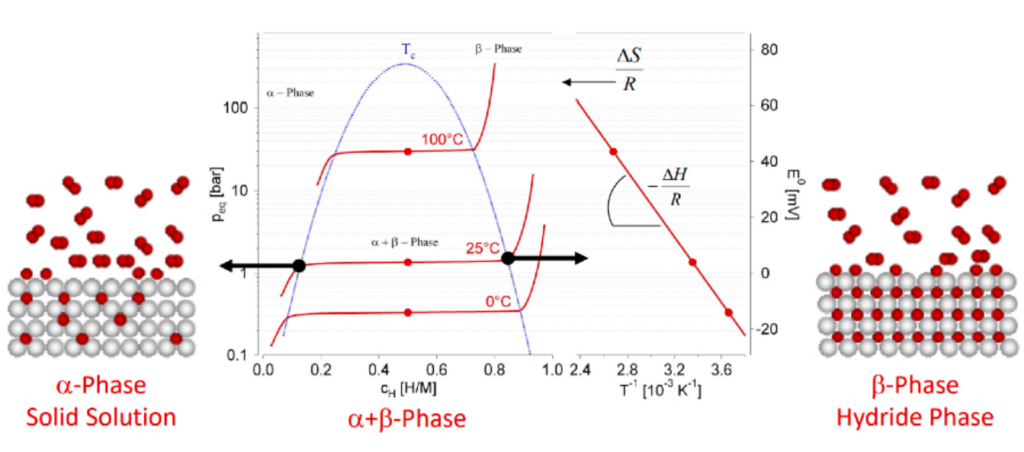
Caractéristiques thermiques #
La compréhension de ce processus endothermique est cruciale pour optimiser les systèmes de stockage d’hydrogène, car il influence l’efficacité et le taux de libération d’hydrogène. Une bonne gestion de la dynamique thermique impliquée peut améliorer la sécurité et les performances de ces systèmes, assurant un approvisionnement stable en hydrogène gazeux en cas de besoin.
Ce phénomène se produit au niveau atomique et a de vastes implications pour le comportement macroscopique du système et ses caractéristiques de sécurité.
Haute sécurité inhérente #
Lorsqu’une fuite se produit, seule une fraction limitée de l’hydrogène stocké peut s’échapper immédiatement. L’hydrogène qui s’échappe refroidit rapidement le système, le conduisant vers un nouvel état d’équilibre. En conséquence, le taux de fuite diminue et peut éventuellement s’arrêter complètement. Cet arrêt se produit soit parce que la température locale devient trop basse pour soutenir la déshydrogénation, soit parce que l’ouverture par laquelle l’hydrogène s’échappe gèle. La figure ci-dessous illustre un module de stockage dont l’hydrogène a été retiré à un débit très élevé, provoquant le gel du module. Cela illustre le processus décrit, soulignant comment une fuite rapide d’hydrogène peut induire une congélation, scellant ainsi l’ouverture et empêchant d’autres fuites.

La limitation ou l’arrêt des flux de fuite permet de détecter longtemps l’hydrogène qui s’échappe
avant que la limite inférieure d’explosion du mélange hydrogène/air ne soit atteinte. En raison de ce qui précède
, les propriétés physiques inhérentes au système lui-même garantissent que suffisamment de temps est
disponibles pour prévenir de manière fiable la création d’un mélange explosif avec des mesures appropriées. Si vous souhaitez plus d’informations sur le comportement thermique des systèmes, veuillez également lire cet article.





